L'incidenza dell'obesità è in costante aumento, triplicando a livello globale tra il 1975 e il 2016, con un costo elevato per la salute pubblica . L'obesità predispone gli individui a varie malattie, compreso il cancro, e il numero di decessi associati all'obesità a livello globale ogni anno (stimato in 2,8 milioni) è in scala simile ai decessi associati a COVID-19 segnalati nella pandemia in corso. Sebbene le diete ricche di grassi abbiano preso gran parte della colpa per l'aumento dell'obesità, il consumo eccessivo di zuccheri trasformati e sciroppo di mais ad alto contenuto di fruttosio (HFCS) in particolare, è fortemente implicato nell'obesità indotta dalla dieta. Se e come il fruttosio causi l'obesità negli esseri umani rimane una questione molto dibattuta. In un reportage su Nature questo dovrebbe far pensare due volte prima di ingurgitare bevande zuccherate con snack grassi, Taylor et al. propongono che gli HFC promuovano l'obesità aumentando la capacità dell'intestino di assorbire i nutrienti.
Prova è emersa che l'intestino tenue funge da gatekeeper per il corpo dei mammiferi contro gli effetti nocivi del fruttosio, il principale dei quali l'accumulo anormale di grasso (steatosi definito) nel fegato. Quantità moderate di fruttosio, ad esempio quelle ingerite durante il consumo di frutta, vengono assorbite e scomposte dalle cellule intestinali. Quantità eccessive, come quelle che potrebbero essere ingerite dopo aver bevuto una bevanda zuccherata, sopraffanno la capacità di assorbimento dell'intestino e il fruttosio "fugge" nel flusso sanguigno per raggiungere il fegato intatto, oppure fuoriesce dall'intestino tenue e raggiunge il colon.
Il fruttosio che finisce nel colon viene scomposto dai batteri residenti per produrre molecole che possono quindi alimentare la sintesi dei lipidi nel fegato. Inoltre, il fruttosio aumenta la "permeabilità" intestinale, una condizione in cui le connessioni allentate tra le cellule intestinali consentono ai nutrienti ingeriti e alle tossine dai batteri nel colon di sfuggire al fegato, dove attivano i segnali infiammatori delle cellule immunitarie che aumentano la steatosi. Pertanto, l'eccesso di fruttosio danneggia il fegato sia direttamente che indirettamente attraverso cambiamenti nell'intestino.
Lo studio di Taylor e colleghi rivela che il fruttosio ha un effetto precedentemente sconosciuto sulla struttura dell'intestino. Il lavoro precedente aveva dimostrato che l'HFCS promuove le vie metaboliche che supportano la formazione di tumori del colon, quindi gli autori si sono chiesti quali conseguenze potrebbe avere una dieta ricca di HFCS per le cellule intestinali non cancerose. Taylor et al. hanno scoperto che i topi nutriti con HFCS avevano protrusioni intestinali più lunghe - strutture note come villi - e assorbivano più nutrienti dietetici rispetto ai topi che non ricevevano HFCS nella loro dieta. Inoltre, le diete grasse causavano un aumento di peso ancora maggiore nei topi se tali diete contenevano anche fruttosio rispetto a quando non lo contenevano.
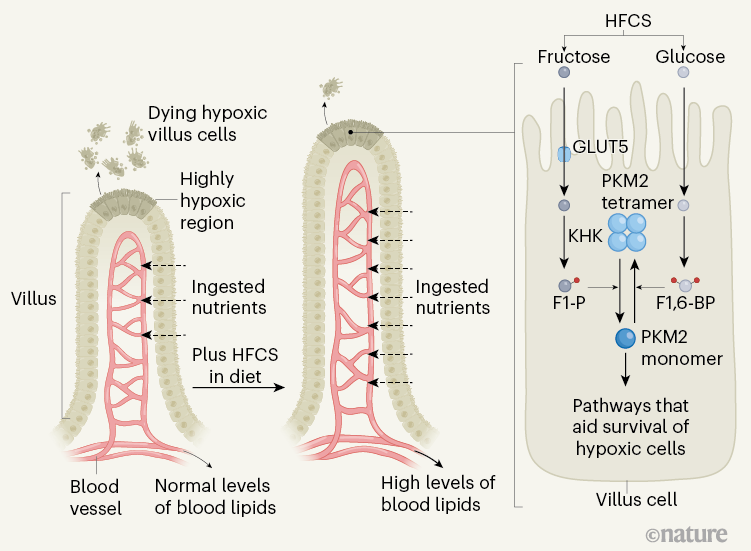
Figura 1 | Cambiamenti intestinali mediati dal fruttosio. I nutrienti nell'intestino entrano nel flusso sanguigno dopo aver attraversato le cellule in una sporgenza intestinale chiamata villo. Le cellule sulla punta di un villo hanno un accesso limitato all'ossigeno (uno stato chiamato ipossia) e muoiono per motivi come l'esaurimento di energia e lo stress ossidativo. Taylor et al. 4riferiscono che, se i topi ricevevano sciroppo di mais ad alto contenuto di fruttosio (HFCS) nella loro dieta, avevano villi più lunghi e livelli più elevati di lipidi nel sangue rispetto agli animali che non ricevevano HFCS. Gli autori suggeriscono che l'allungamento dei villi è dovuto all'aumento della sopravvivenza delle cellule ipossiche attraverso cambiamenti innescati dalla presenza di fruttosio. Il glucosio da HFC viene metabolizzato, guadagnando due gruppi fosfato (cerchi rossi) per generare la molecola fruttosio 1,6-bisfosfato (F1,6-BP), che favorisce la formazione della versione tetramerica ad alta attività dell'enzima PKM2. Questo enzima funziona in una via metabolica chiamata glicolisi. Quando il fruttosio dell'HFCS entra nelle cellule attraverso il trasportatore GLUT5, l'enzima chetoesochinasi (KHK) lo converte in fruttosio 1-fosfato (F1-P), che è strutturalmente simile a F1,6-BP. A differenza di F1,6-BP, F1-P provoca la dissociazione delle subunità PKM2 e sposta l'equilibrio dai tetrameri PKM2 attivi ai monomeri PKM2 a bassa attività. I monomeri PKM2 aumentano la sopravvivenza delle cellule dei villi nell'ipossia sopprimendo lo stress ossidativo e inducendo l'espressione di geni che aiutano a sostenere i livelli di energia.
Quando un villo si allunga quando si formano nuove cellule, le cellule intestinali più vecchie si spostano sulla punta dei villi, lontano dai vasi sanguigni, e sperimentano una limitazione gradualmente crescente nella disponibilità di ossigeno (entrando in uno stato chiamato ipossia). Gli autori riportano prove che sulla punta dei villi, dove l'ipossia era estrema, le cellule stavano morendo. Taylor e colleghi hanno anche scoperto che nuove cellule nei villi in crescita di topi alimentati con HFCS si sono formate a velocità simili a quelle dei topi senza HFCS nella loro dieta. Insieme, queste osservazioni suggeriscono che la morte cellulare indotta dall'ipossia limita la lunghezza dei villi e che i villi dei topi alimentati con HFCS erano più lunghi perché le loro cellule avevano meno probabilità di morire rispetto alle cellule ipossiche nei villi dei topi che non erano stati alimentati con HFCS.
Taylor et al. studiato come il fruttosio potrebbe promuovere la sopravvivenza delle cellule ipossiche. L'analisi degli autori delle cellule coltivate in vitro ha rivelato che il fruttosio ha determinato un aumento del livello di F1-P. Inoltre, il trattamento di queste cellule con fruttosio ha inibito la via metabolica della scomposizione del glucosio chiamata glicolisi nella fase catalizzata dall'enzima PKM2. La bassa attività PKM2 aiuta a reindirizzare le molecole intermedie dalla via della glicolisi alle vie biosintetiche e antiossidanti che consentono alle cellule di proliferare e sopravvivere sotto stress. Varie molecole intracellulari si legano e commutano PKM2 tra una forma tetramerica ad alta attività (contenente quattro subunità proteiche) e una forma monomerica a bassa attività (contenente una subunità proteica), a seconda dello stato della cellula. PKM2 monomerico può spostarsi nel nucleo per supportare il fattore di trascrizione HIF-1α nel guidare l'espressione di geni che aiutano le cellule ipossiche a mantenere le loro riserve energetiche
Gli autori hanno scoperto che F1-P si lega a PKM2, probabilmente in virtù della sua somiglianza strutturale con il fruttosio 1,6-bisfosfato (F1,6-BP), una molecola della via della glicolisi che può attivare PKM2. A differenza di F1,6-BP, F1-P spinge PKM2 ad adottare una forma monomerica a bassa attività. Questo aiuta le cellule intestinali ipossiche alimentate con fruttosio a ridurre lo stress ossidativo e aumenta l'attività di HIF-1α per preservare i livelli di energia. Quando Taylor e colleghi hanno somministrato ai topi TEPP-46, una piccola molecola che blocca PKM2 in una forma tetramerica attiva che elude l'inibizione di F1-P, questo ha impedito l'allungamento dei villi nei topi alimentati con HFCS, indicando che F1-P derivato dal fruttosio aiuta le cellule ipossiche nei villi in crescita per sopravvivere controllando PKM2.
Per indagare ulteriormente sul ruolo di PKM2 e KHK nell'allungamento dei villi, gli autori hanno eliminato la parte del gene Pkm che codifica specificamente per PKM2 o il gene Khk . La modifica di Pkm per prevenire l'espressione di PKM2 ha guidato l'espressione di una versione alternativa di Pkm che codifica per una proteina chiamata PKM1, che è sempre attiva, in modo simile a PKM2 legato a TEPP-46. Queste delezioni genetiche hanno impedito l'allungamento dei villi come conseguenza di una dieta a base di HFCS e, soprattutto, hanno ridotto il livello di lipidi nel sangue nei topi alimentati con HFCS rispetto al livello nei topi in cui i geni non erano stati eliminati. Ciò suggerisce che l'allungamento dei villi indotto dal fruttosio consente un maggiore assorbimento dei grassi alimentari.
Taylor et al . poi hanno studiato se i loro risultati nell'intestino normale fossero rilevanti anche per i tumori intestinali. Hanno trovato cellule ipossiche nei tumori intestinali di topi geneticamente predisposti a sviluppare questi tumori. Come precedentemente descritto, nutrire tali topi con HFCS ha portato a tumori più grandi rispetto a nutrirli con diete senza HFCS. Sebbene il trattamento di topi alimentati con HFCS con TEPP-46 non abbia eliminato questi tumori, ha impedito gli effetti di promozione del tumore dell'HFCS. Gli autori hanno anche osservato una maggiore espressione dei geni bersaglio HIF-1α e una bassa attività PKM2 in campioni di tumori del colon-retto umani rispetto a tessuti vicini, non cancerosi. Insieme, questi risultati suggeriscono che, analogamente alla situazione delle cellule ipossiche nei villi in crescita, uno stato di bassa attività di PKM2 potrebbe anche supportare la crescita del tumore consentendo alle cellule tumorali intestinali di sopravvivere all'ipossia.
Questo lavoro fornisce prove convincenti che PKM2 e il suo ligando F1-P appena descritto mediano gli effetti precedentemente non apprezzati del fruttosio nei tessuti intestinali sia normali che cancerosi. I risultati sollevano anche diverse domande relative alla nostra attuale comprensione di come l'intestino gestisce i nutrienti. Negli animali sani, gli enzimi intestinali chiamati lipasi scompongono i lipidi ingeriti in prodotti che vengono assorbiti dalle cellule intestinali e riconfezionati per la consegna attraverso il sistema linfatico e nel sangue. Quindi la domanda su come i lipidi alimentari ingeriti causino un aumento dei lipidi nel sangue, come sembrano fare nei topi alimentati con HFCS anche quando le lipasi sono inibite, secondo Taylor e colleghi, richiede ulteriori indagini. Forse l'allungamento dei villi è legato alla permeabilità intestinale e, quando i cibi grassi sopraffanno la capacità enzimatica delle lipasi, i lipidi in eccesso nella dieta bypassano le cellule intestinali e penetrano nel flusso sanguigno.
Il consumo di fruttosio aumenta il livello di espressione del trasportatore GLUT5 che aiuta l'ingresso del fruttosio nelle cellule , migliorando così l'assorbimento del fruttosio. Non è chiaro se l'allungamento dei villi fornisca un'ulteriore spinta all'assorbimento del fruttosio, che potrebbe ridurre la fuoriuscita di fruttosio nel colon e nel fegato come conseguenza del consumo persistente di fruttosio. In tale scenario, anche se l'allungamento dei villi favorisce l'assorbimento dei grassi, potrebbe anche mitigare in parte gli effetti dannosi del fruttosio stesso sul fegato. Sarà interessante determinare come il complesso equilibrio tra le capacità di assorbimento e metaboliche dell'intestino di fruttosio, lipidi e altri nutrienti e l'intersezione di questi processi con l'attività dei microrganismi nel colon contribuiscano insieme alle condizioni legate all'obesità.
Considerando il potenziale terapeutico di questo lavoro, gli esperimenti degli autori suggeriscono fortemente che PKM2 supporta la sopravvivenza delle cellule intestinali in cui è espresso. Tuttavia, PKM2 è espresso anche in molti altri tipi di cellule, come le cellule immunitarie, che mediano le funzioni necessarie per mantenere la salute sia dell'intestino che del fegato.
Curiosamente, nonostante la sua capacità di prevenire l'allungamento dei villi mediato dall'HFCS, TEPP-46 non ha migliorato la steatosi epatica negli esperimenti degli autori. Questo risultato contrasta con la diminuzione della steatosi indotta da fruttosio che gli autori hanno osservato con il Pkmcancellazione che impedisce l'espressione di PKM2. Questa discrepanza tra gli approcci genetici e farmacologici alla modulazione di PKM2 aumenta la possibilità che l'azione combinata degli attivatori di PKM2 su più tipi di cellule possa in definitiva determinare la loro capacità di modulare specifiche funzioni tissutali nella malattia. Nonostante le prime speranze, gli attivatori di PKM2 devono ancora raggiungere la clinica come terapie contro il cancro. Il lavoro di Taylor e colleghi evidenzia il fatto che acquisire una comprensione approfondita dei contesti tissutali e patologici potrebbe consentire ai ricercatori di suggerire nuove aree terapeutiche in cui l'attivazione di PKM2 potrebbe rivelarsi utile. Indipendentemente da ciò, evitare del tutto le bevande zuccherate potrebbe essere un buon inizio per frenare l'obesità.
fonte: Nature

